がん抑制遺伝子は傷ついた遺伝子を修復したり異常になった細胞を排除したりして、細胞のがん化を防ぐために働く遺伝子である。しかしがんや白血病、悪性リンパ腫などの腫瘍細胞では、このようながん抑制遺伝子が働けなくなっている。
東京大学などの研究グループは、このようながん抑制遺伝子の働きを抑えるメカニズムと、関与する酵素EZH1およびEZH2を特定、その酵素を2つ同時に阻害する化合物も開発した。この化合物はがん細胞を特異的に死滅させ、ウイルスに感染した前がん状態の細胞にも効果をあらわした。今後、腫瘍疾患の新たな治療法や予防法の開発につながっていくことが期待される。
本研究は、東京大学大学院の山岸誠特任講師、内丸薫教授、東京大学の渡邉俊樹名誉教授、第一三共の本間大輔氏、荒木一司氏らの研究グループにより、19日の「Cell Reports」誌に掲載された。
遺伝子の働きを制御する仕組みの一つにエピゲノムがある。DNA配列自体が変化するのではなく、DNAに結合するタンパク質であるヒストンなどの変化による働きの制御である。例えばヒストンやDNAがメチル化されて構造が凝集すると遺伝子の発現は抑えられ、逆に構造がゆるむと発現が促進する。多くのがん細胞ではエピゲノムの変化がみられ、その結果がん抑制遺伝子が働くことができなくなっている。
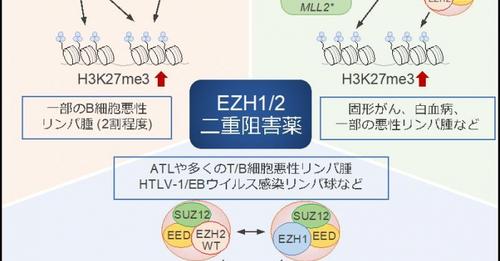
悪性リンパ腫、急性白血病などの造血器腫瘍や、乳がん、前立腺がん、肺がん、肝臓がん、膵臓がん、脳腫瘍などの多くの固形がんで蓄積していることが知られているH3K27me3は、27番目のリジン残基が3つメチル化されているヒストンである。このH3K27me3を誘導する酵素EZH2については、これまでも研究が行われてきていたが、十分に良い結果が得られてこなかった。しかし今回、2つの酵素EZH1とEZH2が悪性リンパ腫に共存し、協調して働いていることを研究グループは明かにした。
次にATL(成人T細胞白血病)由来の培養細胞を用いて、酵素EZH1とEZH2を片方ずつノックダウンした。すると、一方の酵素の働きを抑えるともう一方の酵素が働きを補うことでH3K27me3は誘導され続け、がん抑制遺伝子の働きは抑制されたままだった。そのため、がん抑制遺遺伝子を働けるようにするには両酵素を同時に抑える必要があると考えた。
そこで研究グループは、第一三共と共同で、酵素EZH1とEZH2を同時に標的にする新規化合物を選別した。この化合物の効果を、悪性リンパ腫などの複数のエピゲノムに異常がみられる腫瘍の培養細胞で検討した。するとこの化合物はH3K27me3の量を減少させ、細胞の遺伝子の状態を正常にして、がん細胞の増殖を抑える働きをした。また、ATLや、HTLV-1、Epstein-barr (EB)ウイルスに感染した前がん状態の細胞にも同様の効果をあらわした。
これらの結果より現在第一三共は、ATLを含む再発難治T細胞リンパ腫に対する EZH1/2阻害薬 (Valemetostat/DS-3201)の医薬品としての承認に向けて、その第1相臨床試験を実施中である。この化合物が臨床試験で効果をあらわすことができれば、悪性リンパ腫やATLなどの疾患の治療に大きく貢献していくだろう。また今後、前がん状態からのがんの発症予防のにも期待していきたい。
https://www.zaikei.co.jp/article/20191124/540817.html